Medicamento para o pé diabético vai ser testado nos EUA
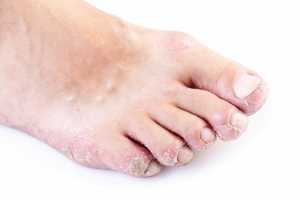
A solução para os casos de pé diabético resistente aos antibióticos está nas mãos da Technophage, uma empresa portuguesa de biotecnologia que está a investigar um novo fármaco para esta doença e que acaba de receber autorização dos EUA para avançar para os primeiros ensaios clínicos em humanos naquele país. O TP_102, nome de código do fármaco que recupera um tratamento que já era utilizado na Europa de Leste na década de 1950, torna-se assim no primeiro medicamento biológico português a receber luz-verde por parte do regulador norte-americano, a Food and Drug Administration (FDA), avança o jornal Público.
O director executivo da Technophage, Miguel Garcia, explicou ao Público que o medicamento inovador, que começou a ser desenvolvido em 2005 aquando do nascimento da empresa, em parceria com a farmacêutica portuguesa Tecnifar, tem como base um “cocktail de bacteriófagos”, isto é, um conjunto de vírus capazes de infectar as bactérias presentes no chamado pé diabético e que provocam úlceras que podem levar à necessidade de amputar os membros inferiores. Na categoria dos medicamentos biológicos, o TP_102 é o primeiro de origem portuguesa a chegar a esta fase de ensaios clínicos nos EUA, que até agora só tinham deixado avançar medicamentos químicos, isto é, que não têm como base matéria viva.
A prevalência da diabetes em Portugal é de cerca de 13% e estas infecções que resultam de complicações atingem quase 25% dos doentes, que ficam com um risco de amputação 15 a 30 vezes superior ao de uma pessoa sem a patologia. Todos os anos são feitas quase 1500 amputações relacionadas com o pé diabético. Apesar de nos últimos anos se ter conseguido reduzir o número de casos com a aposta nos cuidados de saúde primários, os dados mais recentes apontam para um revés: o relatório do Observatório Português dos Sistemas de Saúde destacou, no final de Junho, que houve uma inversão nas estatísticas desta doença, com os especialistas a reportarem em 2012 um aumento das amputações de membros inferiores, que cresceram 8,9% depois de estarem sempre a descer desde 2008.
Sobre o funcionamento do medicamento em investigação, Miguel Garcia adiantou que os “bacteriófagos são entidades que eliminam especificamente as bactérias”. “O nosso objectivo é combater as resistências bacterianas que existem aos antibióticos e percebemos que este produto as elimina e dá resposta a um problema médico não resolvido e que é um problema real, já que muitas infecções de pé diabético evoluem para amputação, levando mesmo por vezes à morte”, disse. O também investigador adiantou, ainda, que estes vírus “infectam directa e especificamente as bactérias hospedeiras, replicando-se dentro da própria bactéria e rebentando-a quando sai para o ambiente”. O ciclo repete-se até já não existirem bactérias.
Até agora a Technophage esteve a trabalhar nos modelos in vitro e em animais, que comprovaram a segurança e eficácia do medicamento. De tal forma que os ensaios de fase I em humanos, autorizados pela FDA, poderão ser feitos já em pessoas doentes, nas quais a solução líquida será aplicada directamente nas feridas, em vez de se ter de testar primeiro em voluntários saudáveis.
Miguel Garcia ainda não tem prazos definidos, estando a ultimar os protocolos e a ver se há necessidade de juntarem mais parceiros ao projecto que vai decorrer nos EUA por questões de protocolo. Até agora os ensaios foram em Portugal. O responsável acredita que o novo ensaio deverá contar com uma amostra de doentes “na casa das dezenas ou das centenas”. Quanto à chegada do TP_102 ao mercado, é prudente e admite que, mesmo se correr tudo dentro do previsto, não deve demorar menos de seis anos. “Por ser uma patologia não resolvida e com forte necessidade de medicação esperamos que o processo possa ser mais rápido”, explicou, adiantando que não excluem a hipótese de em fases mais avançadas venderem o produto a uma grande farmacêutica.
Por o TP_102 ser um medicamento biológico, ou seja, produzido a partir de matéria viva, Miguel Garcia já estava confiante de que seria seguro e pouco tóxico. Além disso, contou que “já foram utilizadas soluções semelhantes na Europa de Leste há algumas décadas, como a de 1950, 1960 e até 1980, mas sem o controlo do ponto de vista regulamentar pelo que os dados não podem ser usados, mas conferem uma enorme expectativa de segurança e de eficácia desta terapia como alternativa para as bactérias resistentes aos antibióticos”.
A empresa, que funciona nas instalações do Instituto de Medicina Molecular da Faculdade de Medicina da Universidade de Lisboa, tem várias parcerias com a academia, mas também com outros países como a Holanda e a China. No total, a Technophage está a trabalhar em mais 11 projectos, sendo que os que estão em fases mais avançadas são na área da artrite reumatóide, osteoporose e doença de Parkinson.
