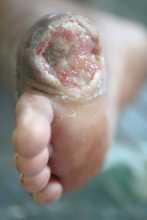
FDA concede designação Fast Track a “cocktail de bacteriófagos” português para tratamento de úlceras do pé diabético
“A designação Fast Track agora concedida pela FDA ao TP-102 poderá acelerar o seu desenvolvimento, permitindo à Technophage trabalhar em estreita colaboração com a Agência na preparação das fases clínicas desta terapia biológica inovadora”, disse Miguel Garcia, CEO da Technophage. “Enquanto outros tratamentos antimicrobianos para esta indicação clínica não conseguem atingir o tecido afetado de forma adequada, os bacteriófagos conseguem replicar na sua bactéria hospedeira, eliminando a infeção bacteriana localmente”, complementou o CEO.
As infeções do pé diabético constituem um problema médico significativo a nível mundial e a incidência destas feridas terá tendência a aumentar com o envelhecimento global da população. Muitos pacientes diabéticos são portadores de úlceras infetadas ao longo da vida, das quais, cerca de 28% acabarão por evoluir negativamente, sendo necessária amputação, o que contribui para um aumento da morbilidade e mortalidade destes doentes.
A Technophage está atualmente a conduzir um ensaio clínico de Fase I/IIa (NCT04803708) com o objetivo de avaliar a segurança e tolerabilidade do TP-102 em pacientes diabéticos como um tratamento tópico para infeções causadas por agentes patogénicos críticos (estudo REVERSE). Os resultados do estudo são esperados em 2021.
