Cientistas determinam estrutura de uma proteína intestinal que pode ajudar a projetar medicamentos mais eficientes
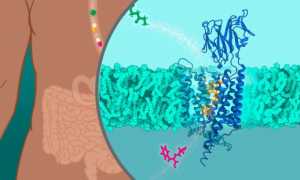
A forma como o corpo humano absorve nutrientes é fundamental não só para a alimentação, mas também para a eficácia dos medicamentos. Investigadores do Laboratório Europeu de Biologia Molecular (EMBL) em Hamburgo e do Centro de Biologia de Sistemas Estruturais (CSSB) determinaram a estrutura molecular do transportador de peptídeos 1 (PepT1), uma pequena proteína que transporta proteínas digeridas do intestino para a corrente sanguínea. Conseguiram-no usando crio-microscopia eletrónica. O PepT1 também transporta muitos fármacos, incluindo antibióticos e antivirais. O processo de absorção de fármacos orais e intestinais é muitas vezes ineficiente, uma vez que apenas uma pequena fração do fármaco passa para a corrente sanguínea. Conhecendo a estrutura molecular do PepT1, os cientistas serão capazes de projetar ou modificar medicamentos para que possam ser absorvidos de forma mais eficiente.
A proteína promíscua que nos mantém nutridos
Durante a digestão, as proteínas que comemos são divididas em pedaços mais pequenos chamados peptídeos, que consistem em aminoácidos que o nosso corpo mais tarde usa para construir as suas próprias proteínas. Antes que isso aconteça, os péptidos devem primeiro ser transportados do intestino para a corrente sanguínea. Esta tarefa é executada por uma molécula chamada peptídeo transportador 1 (PepT1), que se situa na membrana celular da parede do intestino e move pequenos peptídeos através da membrana celular.
No corpo humano, existem cerca de 800 sistemas de transporte dedicados a diferentes tipos de nutrientes. A maioria é muito especializada. Por exemplo, certos transportadores de açúcar podem ocupar apenas um tipo de açúcar. No entanto, o PepT1 é diferente – pode transportar quase qualquer tipo de peptídeo curto. No jargão científico, esta capacidade é referida como "promiscuidade".
O líder do grupo, Christian Löw é o perito do EMBL Hamburgo em proteínas da membrana. O seu grupo, juntamente com colegas do Centro de Biologia dos Sistemas Estruturais (CSSB) e da Universitätsklinikum Hamburg-Eppendorf (UKE), determinaram as estruturas moleculares do PepT1 humano e do seu pept2 relativo, que está presente principalmente no rim para reabsorção de nutrientes. Os cientistas usaram crio-microscopia eletrónica.
Novas possibilidades para melhorar o design de fármacos
A promiscuidade do PepT1 permite-lhe transportar não só peptídeos nutritivos, mas também vários tipos de fármacos, incluindo certos antibióticos, antivirais e medicamentos para a hipertensão. No entanto, o PepT1 transporta os fármacos de forma menos eficiente do que transporta muitos dos peptídeos naturais. Como consequência, apenas uma fração dos medicamentos que tomamos acabam na nossa corrente sanguínea. O resto permanece no intestino, o que pode levar a vários efeitos colaterais. Aumentar a dose de medicamentos para compensar o transporte ineficiente é particularmente perigoso no caso dos antibióticos, porque pode levar à geração de bactérias resistentes aos antibióticos.
"Agora que sabemos como é a estrutura pept1, será possível conceber novos fármacos que explorem o PepT1 para atravessar a parede intestinal de forma muito mais eficiente do que antes", disse Löw. "A estrutura do PepT1 humano vai permitir-nos melhorar o design de fármacos, tornando a absorção mais eficiente. Atualmente, é quase impossível prever se um candidato a medicamento pode atravessar o muro do intestino através deste sistema de transporte. Até agora, a obtenção de tal fármaco tem sido muito desafiante. Muitos candidatos a fármacos potencialmente eficazes falharam em estudos pré-clínicos porque foram mal absorvidos. Com a ajuda da informação estrutural para o PepT1, alguns desses candidatos falhados poderiam ser redesenhados para que pudessem ser transportados de forma eficiente pelo PepT1. Da mesma forma, muitos medicamentos existentes poderiam ser modificados para melhorar a sua absorção."
Assistindo o transportador em stop-motion
A estrutura molecular do PepT1 humano está entre as estruturas mais pequenas determinadas com crio-microscopia eletrónica. Assemelha-se a uma pinça que está aberta para o interior do intestino. Quando um peptídeo se liga ao PepT1, o grampo fecha-se à sua volta e abre-se para o outro lado da membrana para o libertar. Os cientistas não só determinaram a estrutura do transportador, como também a capturaram em vários estados ao longo do ciclo de transporte.
"Visualizamos todo o processo de transporte em detalhe molecular, como num filme", disse Maxime Killer, primeiro autor do estudo. "As proteínas da membrana são notoriamente difíceis de estudar, mas esperamos que os truques que desenvolvemos para estudar o PepT1 ajudem outros cientistas a resolver as estruturas de proteínas semelhantes no futuro."
