Biologia estrutural revela novas oportunidades para combater a tuberculose
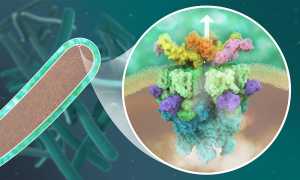
A tuberculose é causada por uma bactéria – Mycobacterium - que infeta os pulmões humanos e outros órgãos utilizando estruturas moleculares complexas. Estas incluem complexos proteicos conhecidos como sistemas de secreção tipo VII, que permitem a M. tuberculose libertar moléculas no seu hospedeiro, que desarmam e, em última análise, matam a célula humana infetada. Cinco desses sistemas de secreção, rotulados ESX-1 a ESX-5, encontram-se entre m. tuberculose e outras micobactérias estreitamente relacionadas, muitas das quais são patogénicas. Sem elas, as bactérias são incapazes de infetar as células humanas.
O grupo Wilmanns do Laboratório Europeu de Biologia Molecular (EMBL, sigla em inglês) Hamburgo tem usado biologia estrutural de alta resolução para estudar proteínas micobacterianas nas últimas duas décadas. A compreensão molecular da maquinaria bacteriana usada para infetar as células resultou em colaborações com a indústria para desenvolver novos fármacos contra a tuberculose.
No seu estudo mais recente, determinou a estrutura molecular do sistema de secreção ESX-5 com um alto nível de detalhe. Os investigadores do grupo viram que o núcleo do ESX-5 é construído de 30 unidades proteicas, que formam um poro dinâmico da membrana para permitir a secreção de proteínas que permitem que a bactéria sobreviva e se multiplique dentro das células humanas. O conhecimento da estrutura ESX-5 em alta resolução é essencial para direcionar locais específicos com drogas de pequenas moléculas.
"A nossa nova estrutura do complexo de secreção ESX-5 fornece uma visão profunda de um grande portão que separa o interior destas bactérias do ambiente exterior do hospedeiro. A abertura deste portão permite que o agente patogénico cuspa as suas armas mortais para infetar os humanos para desenvolver tuberculose. Podemos usar esta estrutura como uma caixa de ferramentas com literalmente milhares de potenciais alvos de drogas. Isto abrirá um campo inteiramente novo de estudos sobre a tuberculose", diz Matthias Wilmanns, que lidera o estudo. Kate Beckham, que desenvolveu uma forma inovadora de isolar o ESX-5, acrescenta: "O poro central que vimos no ESX-5 pode servir como um novo alvo de drogas. Bloqueá-lo poderia prevenir a infeção com micobactérias patogénicas."
O estudo também pode ajudar os cientistas a desenvolver novas vacinas para a tuberculose. A vacina bacillus Calmette-Guérin (BCG) muito utilizada, que tem este ano o seu 100º aniversário, baseia-se numa estirpe de micobacterium que perdeu a capacidade de causar doenças devido a um defeito no sistema ESX-1. No entanto, uma vez que a vacinação BCG oferece uma proteção insuficiente e é mais eficaz apenas em bebés jovens, são necessárias vacinas alternativas. Devido à sua estreita relação estrutural e funcional com o ESX-1, o sistema de secreção ESX-5 pode estimular o desenvolvimento de novas vacinas que possam complementar ou substituir as atualmente utilizadas.
Determinar a estrutura molecular do ESX-5 foi particularmente desafiante devido ao seu grande tamanho e complexidade. Nenhum método de biologia estrutural pode fornecer o quadro completo. Neste caso, a chave para o sucesso foi a utilização de biologia estrutural integrativa, na qual os dados obtidos utilizando diferentes métodos – microscopia crio-eletrão, cristalografia de raios-X, espectrometria em massa e métodos computacionais – foram usados conjuntamente para criar um modelo coerente.
"Há 18 meses, resolver esta estrutura parecia uma missão impossível", diz Matthias Wilmanns. “Conseguimos juntar as peças do puzzle porque cada membro da equipa contribuiu com uma experiência única. Para resolver a estrutura completa, colaborámos com o grupo de Jan Kosinski no EMBL Hamburgo e com o Centro de Biologia de Sistemas Estruturais, que forneceu os conhecimentos necessários em biologia estrutural integrativa. Também recebemos uma grande ajuda dos nossos colegas do EMBL Heidelberg, que realizaram experiências de microscopia crio-electrária."
